
La gestione delle risorse genetiche viticole prevede tradizionalmente la conservazione del germoplasma come collezioni in pieno campo. Ma per un’efficace conservazione della biodiversità questo approccio può essere oggi affiancato ed integrato da moderne tecnologie. Uno dei possibili metodi per la salvaguardia ex-situ (cioè fuori dal proprio habitat naturale) del germoplasma è rappresentato dalla conservazione in vitro. Questa tecnica prevede il mantenimento del materiale vegetale in un ambiente sterile…
LEGGI L’ARTICOLO COMPLETO A FIRMA DI IVANA GRIBAUDO E MASSIMO GARDIMAN
PER APPROFONDIRE
(Approfondimenti a cura degli Autori)
Variabilità somaclonale ed epigenetica
In piante di vite ottenute da micropropagazione sono riportate alcune modificazioni fenotipiche, principalmente a livello fogliare in Vitis vinifera (Grenan, 1984; Deloire et al., 1995; Gribaudo et al., 2000; Gheorghe et al., 2009) ma queste tendono a scomparire dopo alcuni anni, mentre nei portinnesti non sono state segnalate differenze rilevanti (Deloire et al., lc; Gardiman e Migliaro, 2012). Nella vite differenze a livello genetico sono state riscontrate (con AFLP e MASP) in piante rigenerate da antere (Popescu et al., 2002) ed embrioni somatici (Schellenbaum et al., 2008; Baranek et al., 2009, 2010). Studi su V. vinifera micropropagata per segmenti nodali suggeriscono che lo stress durante la moltiplicazione in vitro induca cambiamenti dello stato di metilazione del DNA, ma sembra che l’impatto di questi sia relativamente debole e il livello di uniformità del genoma nelle piante micropropagate sia alto. È molto probabile che l’utilizzo di condizioni e tecniche di coltura maggiormente stressanti (rigenerazione avventizia, embriogenesi somatica, uso di elevate concentrazioni di fitoregolatori ecc.) possa portare ad un maggior grado di variazione somaclonale/epigenetica.
La composizione dei substrati
Nella tabella che segue si riporta la composizione dei substrati di coltura utilizzati per la micropropagazione della vite nei laboratori del CRA-VIT e dell’IVV-CNR. *: formulazione indicata da Murashige e Skoog (1962) a metà concentrazione. **: formulazione indicata da Murashige e Skoog (1962). 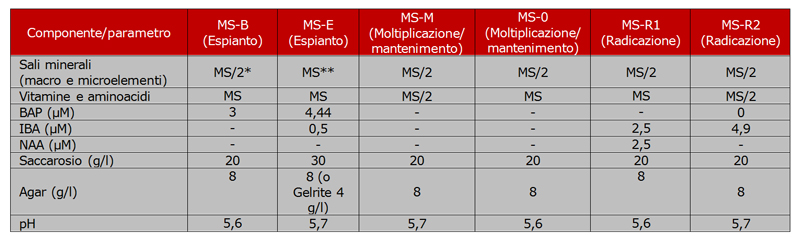
Bibliografia
Baránek M., Krizan B., Ondrusikova E., Pidra M. (2010). DNA-methylation changes in grapevine somaclones following in vitro culture and thermotherapy. Plant Cell Tiss Organ Cult 101:11–22 Baránek M., Raddová J., Krizan B., Pidra M. (2009). Genetic changes in grapevine genomes after stress induced by in vitro cultivation, thermotherapy and virus infection, as revealed by AFLP. Genetics and Molecular Biology, 32 (4): 834-839 Deloire A., Charpentier M., Berlioz G., Colin A., Gimonnet G. (1995). Micropropagation of the grapevine: results of 10 years of experiments in the Champagne vineyard and results of the first vinification. Am. J. Enol. Vitic., 46, 571-578 Gardiman M., Migliaro D. (2012). Coltura in vitro per lungo tempo del portinnesto della vite Kober 5 BB. Acta Italus Hortus, “Atti del 2° convegno nazionale sulla micropropagazione“ 6: 261-264 Gheorghe R.N., Visoiu E., Popescu C.F., Pamfil D. (2009). Assessment of genetic stability and fidelity of some micropropagated Vitis vinifera L. “Feteasca neagra” clones by ampelometric and RAPD markers. Bulletin UASVM Horticulture, 66(1): 51-57 Grenan S. (1984). Polymorphisme foliaire consécutif à la culture in vitro de Vitis vinifera L. Vitis, 23, 159-174 Gribaudo I., Cuozzo D., Ruffa P., Gambino G., Mannini F. (2009). Risanamento da virus di vitigni minori presso l’IVV-CNR, Unità di Grugliasco. Italus Hortus 16(2): 194-197 Gribaudo I., Mannini F., Lisa A., Cuozzo D. (2000). Phenotypical modifications of micropropagated grapevines. Acta Hort 530:231-236 Martini M., Musetti R., Grisan S., Polizzotto R., Borselli S., Pavan F., Osler R. (2009). DNA-dependent detection of the grapevine fungal endophytes Aureobasidium pullulans and Epicoccum nigrum. Plant Disease 93 (10): 993-998 Murashige T., Skoog F. (1962). A revised medium for rapid growth and bioassay with tobacco tissue cultures. Physiologia Plantarum 15: 473-497 Popescu C. F., Falk A., Glimelius K. (2002). Application of AFLPs to characterize somaclonal variation in anther-derived grapevines. Vitis 41 (4):177–182 Schellenbaum P., Mohler V., Wenzel G., Walter B. (2008). Variation in DNA methylation patterns of grapevine somaclones (Vitis vinifera L.). BMC Plant Biology 2008, 8:78 doi:10.1186/1471-2229-8-78 Zanzotto A., Gardiman M., Lovat L. (2008) Effect of Phaeomoniella chlamydospora and Phaeoacremonium sp. on in vitro grapevine plants. Scientia Horticulturae 116 (4): 404–408







