L’anidride solforosa è divenuta un coadiuvante tecnologico di largo utilizzo grazie ai suoi vantaggi nel settore enologico poiché i suoi benefici sono cruciali sia in termini di controllo microbiologico che di prevenzione dei fenomeni di ossidazione. Tuttavia da qualche anno la SO2 viene criticata per i numerosi inconvenienti che essa presenta: - è ritenuta tossica per l’organismo umano, presenta un pericolo per il consumatore e per l’operatore in cantina; - è un possibile precursore di aromi solforati, detti di riduzione, prodotti durante la fermentazione (Henschke et Jiranek, 1991); può anche essere ossidata in solfato, al quale si imputa spesso la secchezza in bocca; può inoltre provocare una maggior formazione di etanale (da parte dei lieviti), altra molecola potenzialmente indesiderata (Cleroux et al, 2015); - il suo odore è percettibile e/o può mascherare certi aromi gradevoli nel vino (Peynaud et Blouin, 1991); - combinandosi con gli antociani, pigmenti dei vini rossi e rosati, provoca la loro decolorazione parziale, certamente reversibile. Per questa ragione numerose ricerche tendono a ridurre il suo impiego in enologia e a trovare alternative. Durante la fase che va dalla vendemmia all’inizio della fermentazione del mosto è facile che si sviluppi una flora indigena, all’interno della quale possono instaurarsi metabolismi indesiderati per ciò che concerne la qualità finale del vino ed il suo aspetto sensoriale: produzione di acido acetico, di ammine biogene, di fenoli volatili o ancora difficoltà di sviluppo dei lieviti enologici inoculati per dar luogo alla fermentazione alcolica (FA). La SO2, nella sua forma molecolare H2SO3, rappresenta quindi uno strumento indispensabile per gestire questi rischi (Deveze, 1977). Si ritiene che un livello di SO2 molecolare di 0,5 mg/L sia battericida, mentre per avere un effetto fungicida è necessario un livello maggiore. Usseglio-Tomasset (1995) ha dimostrato come per ritardare la fermentazione alcolica di 50 ore siano sufficienti 0,5 mg/L di SO2 attiva nei riguardi del S. Cerevisiae e 3,5 mg/L nei riguardi del S. Uvarum. Il pH svolge un ruolo determinante: più è elevato e minore è la concentrazione di SO2 molecolare. Una temperatura bassa, come pure l’assenza di etanolo - condizioni che si presentano nelle fasi prefermentative - riducono considerevolmente l’attività della SO2.
Utilizzo del Metschnikowia fructicola in fase prefermentativa su uve rosse
Macerazione prefermentativa a freddo In certi casi di macerazione prefermentativa denominata a freddo, le temperature sono più difficilmente controllabili e si avvicinano più ai 2-16°C rispetto agli 8°C previsti per un’autentica prefermentazione a freddo. Per questa ragione è stato selezionato un lievito Metschnikowia fructicola privo di potere fermentativo, GaïaTM (Perdomini-IOC) che ha lo scopo di offrire un biocontrollo massiccio con un alto livello di popolazione (dosaggio di 20 g/hL, dell’ordine di 9.106 cellule/mL), limitando il rischio di un avvio precoce della fermentazione alcolica.  La specie di lievito M. fructicola, isolata recentemente (Kurzman et Droby, 2001), si è già distinta per l’inibizione che esercita sulle muffe nelle colture frutticole (Liu et al., 2011) e sulla Botrytis. L’utilizzo di GaïaTM in enologia per la macerazione prefermentativa di uve rosse è già stato descritto da Gerbaux et al. (2015), ma desideriamo elencare qui di seguito alcune delle sue qualità: - ottimo potere di colonizzazione e di moltiplicazione, ma senza potere fermentativo; - contenimento nello sviluppo dei lieviti Kloeckera apiculata, spesso responsabili dell’aumento d’acidità volatile (AV) nella macerazione prefermentativa. La Kloeckera può anche produrre circa dieci volte più acetato di etile rispetto al Saccharomyces (Blondin, 2011). - limitazione dell’AV in situazione di contaminazione da Kloeckera; - assenza di metaboliti indesiderati e migliore attitudine sensoriale rispetto agli altri Metschnikowia testati nel programma di selezione. Un esperimento aggiuntivo condotto su piccoli lotti da 3 kg di uva Syrah nel Vaucluse metteva a confronto i seguenti metodi: - campione di solfitaggio classico (6 g/hL sull’uva prima della diraspatura/pigiatura); - modalità in doppio solfitaggio (oltre al solfitaggio iniziale, aggiunta di 6 g/hL di SO2 supplementare dopo un giorno di macerazione prefermentativa a 10°C); - modalità Gaïa: nessun solfitaggio, ma inoculo di GaïaTM (20 g/hL sull’uva prima della diraspatura/pigiatura). Dopo la macerazione prefermentativa a 10°C per 48 ore, è stato eseguita una conta dei lieviti totali e non-Saccharomyces; dopodiché i lotti sono stati inoculati con il lievito S. cerevisiae IOC 18-2007 (20 g/hL). La popolazione rilevata corrisponde essenzialmente a quella dei lieviti non-Saccharomyces. Il doppio solfitaggio consente una riduzione significativa di tale popolazione potenzialmente contaminante. Si osserva una popolazione considerevole di lieviti non-Saccharomyces nella modalità Gaïa; ciò è coerente con l’ottimo inoculo e moltiplicazione del lievito M. fructicola, poiché è soprattutto questo tipo di lievito che viene identificato mediante studio morfologico al microscopio. Sui due campioni solfitati, invece, si nota una presenza considerevole di lieviti identificati come appartenenti alla specie Hanseniaspora, nota per possedere un potenziale significativo nella produzione d’acido acetico e di etanale (Lonvaud-Funel et al, 2010). A questo titolo, la repressione di questo tipo di flora da parte di M. fructicola sembra migliore o almeno equivalente al solfitaggio iniziale di 6 g/hL. Biocontrollo dell’uva durante il raccolto Un utilizzo più precoce è stato testato di recente. Abbiamo eseguito due esperimenti aggiungendo GaïaTM su delle uve e mosto fresco in container per la vendemmia. L’aggiunta del lievito ad un dosaggio di 20 g per 100 kg di uva raccolta, precedentemente reidratata in acqua a 20-30°C, è stata eseguita in modo omogeneo durante il riempimento dei cassoni. Tale pratica è stata confrontata con campioni solfitati e non. Per assicurarsi dell’omogeneità – sia analitica che microbiologica – della materia prima tra i vari lotti, la vendemmia è stata eseguita a fila alterna per il riempimento dei cassoni. In tutte le modalità, il lievito S. cerevisiae (IOC R 9008) è stato inoculato (20 g/hL) dopo una macerazione prefermentativa di una notte per avviare la fermentazione alcolica. La prima prova, realizzata su Merlot in Gironda, ha permesso di confrontare il metodo tradizionale per mezzo di solfitaggio con una modalità senza solfitaggio, ma con aggiunta di GaïaTM. In questa seconda modalità, è stato operato per sicurezza un lieve solfitaggio (2 g/hL) su due terzi della fermentazione alcolica. Il monitoraggio della popolazione dei lieviti dimostra un’attività di biocontrollo da parte del M. fructicola. Si nota durante la fermentazione in vasca una forte popolazione di lieviti non-Saccharomyces che riflette un ottimo inoculo di GaïaTM, mentre all’uscita della macerazione prefermentativa i lieviti Saccharomyces cerevisiae contaminanti sembrano essere stati repressi da GaïaTM. Nei 2/3 della fermentazione alcolica ciò si traduce con un maggior sviluppo dei S. cerevisiae selezionati con questa modalità. La seconda prova, realizzata sul Cabernet Franc in collaborazione con la Chambre d’Agriculture d’Indre-et-Loire, ha permesso di confrontare 4 modalità: un campione solfitato in modo classico, un campione non solfitato, una modalità non solfitata ma inseminata con GaïaTM sui cassoni e infine una modalità identica fino a questo stadio, ma che differisce poi con l’aggiunta di batteri enologici all’inizio della fermentazione alcolica.
La specie di lievito M. fructicola, isolata recentemente (Kurzman et Droby, 2001), si è già distinta per l’inibizione che esercita sulle muffe nelle colture frutticole (Liu et al., 2011) e sulla Botrytis. L’utilizzo di GaïaTM in enologia per la macerazione prefermentativa di uve rosse è già stato descritto da Gerbaux et al. (2015), ma desideriamo elencare qui di seguito alcune delle sue qualità: - ottimo potere di colonizzazione e di moltiplicazione, ma senza potere fermentativo; - contenimento nello sviluppo dei lieviti Kloeckera apiculata, spesso responsabili dell’aumento d’acidità volatile (AV) nella macerazione prefermentativa. La Kloeckera può anche produrre circa dieci volte più acetato di etile rispetto al Saccharomyces (Blondin, 2011). - limitazione dell’AV in situazione di contaminazione da Kloeckera; - assenza di metaboliti indesiderati e migliore attitudine sensoriale rispetto agli altri Metschnikowia testati nel programma di selezione. Un esperimento aggiuntivo condotto su piccoli lotti da 3 kg di uva Syrah nel Vaucluse metteva a confronto i seguenti metodi: - campione di solfitaggio classico (6 g/hL sull’uva prima della diraspatura/pigiatura); - modalità in doppio solfitaggio (oltre al solfitaggio iniziale, aggiunta di 6 g/hL di SO2 supplementare dopo un giorno di macerazione prefermentativa a 10°C); - modalità Gaïa: nessun solfitaggio, ma inoculo di GaïaTM (20 g/hL sull’uva prima della diraspatura/pigiatura). Dopo la macerazione prefermentativa a 10°C per 48 ore, è stato eseguita una conta dei lieviti totali e non-Saccharomyces; dopodiché i lotti sono stati inoculati con il lievito S. cerevisiae IOC 18-2007 (20 g/hL). La popolazione rilevata corrisponde essenzialmente a quella dei lieviti non-Saccharomyces. Il doppio solfitaggio consente una riduzione significativa di tale popolazione potenzialmente contaminante. Si osserva una popolazione considerevole di lieviti non-Saccharomyces nella modalità Gaïa; ciò è coerente con l’ottimo inoculo e moltiplicazione del lievito M. fructicola, poiché è soprattutto questo tipo di lievito che viene identificato mediante studio morfologico al microscopio. Sui due campioni solfitati, invece, si nota una presenza considerevole di lieviti identificati come appartenenti alla specie Hanseniaspora, nota per possedere un potenziale significativo nella produzione d’acido acetico e di etanale (Lonvaud-Funel et al, 2010). A questo titolo, la repressione di questo tipo di flora da parte di M. fructicola sembra migliore o almeno equivalente al solfitaggio iniziale di 6 g/hL. Biocontrollo dell’uva durante il raccolto Un utilizzo più precoce è stato testato di recente. Abbiamo eseguito due esperimenti aggiungendo GaïaTM su delle uve e mosto fresco in container per la vendemmia. L’aggiunta del lievito ad un dosaggio di 20 g per 100 kg di uva raccolta, precedentemente reidratata in acqua a 20-30°C, è stata eseguita in modo omogeneo durante il riempimento dei cassoni. Tale pratica è stata confrontata con campioni solfitati e non. Per assicurarsi dell’omogeneità – sia analitica che microbiologica – della materia prima tra i vari lotti, la vendemmia è stata eseguita a fila alterna per il riempimento dei cassoni. In tutte le modalità, il lievito S. cerevisiae (IOC R 9008) è stato inoculato (20 g/hL) dopo una macerazione prefermentativa di una notte per avviare la fermentazione alcolica. La prima prova, realizzata su Merlot in Gironda, ha permesso di confrontare il metodo tradizionale per mezzo di solfitaggio con una modalità senza solfitaggio, ma con aggiunta di GaïaTM. In questa seconda modalità, è stato operato per sicurezza un lieve solfitaggio (2 g/hL) su due terzi della fermentazione alcolica. Il monitoraggio della popolazione dei lieviti dimostra un’attività di biocontrollo da parte del M. fructicola. Si nota durante la fermentazione in vasca una forte popolazione di lieviti non-Saccharomyces che riflette un ottimo inoculo di GaïaTM, mentre all’uscita della macerazione prefermentativa i lieviti Saccharomyces cerevisiae contaminanti sembrano essere stati repressi da GaïaTM. Nei 2/3 della fermentazione alcolica ciò si traduce con un maggior sviluppo dei S. cerevisiae selezionati con questa modalità. La seconda prova, realizzata sul Cabernet Franc in collaborazione con la Chambre d’Agriculture d’Indre-et-Loire, ha permesso di confrontare 4 modalità: un campione solfitato in modo classico, un campione non solfitato, una modalità non solfitata ma inseminata con GaïaTM sui cassoni e infine una modalità identica fino a questo stadio, ma che differisce poi con l’aggiunta di batteri enologici all’inizio della fermentazione alcolica. 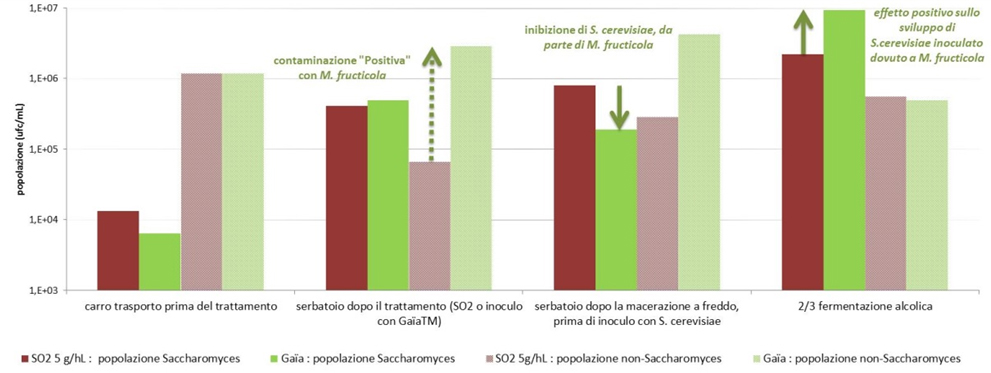
Conclusioni
Di fronte al potere fungicida del solfitaggio nelle fasi prefermentative, alcuni lieviti non-Saccharomyces rappresentano un’alternativa interessante per monitorare la flora microbiologica nel mosto e nell’uva vendemmiata durante le fasi prefermentative e ciò già dalla raccolta dell’uva. A questo riguardo, il lievito GaïaTM, la Metschnikowia fructicola, ha dimostrato più volte la sua sicura efficacia nel controllare (sostituendo parzialmente o addirittura totalmente l’anidride solforosa) una parte della microflora potenzialmente contaminante dell’uva, sia durante la macerazione prefermentativa che durante un utilizzo successivo, tramite l’inoculo dell’uva appena raccolta.
Riferimenti bibliografici
BLONDIN, 2011 : Les levures non-Saccharomyces des flores naturelles des moûts. Matinée technique de l’UOEF – Maîtrise des flores indigènes. PEYNAUD E. et BLOUIN J., 1991 : Le goût du vin. Dunod eds, 2013, 5ème édition, 51-52. 256 p. CLEROUX M., PERNET A., MIRA DE ORDUÑA HEIDINGER R., RIEDO A., MERTENAT M., LI E., 2015 : Effet des levures et des paramètres de vinification sur la dynamique des concentrations en acétaldéhyde. Revue suisse de viticulture arboriculture horticulture 47(4), 232-237. DEVEZE M., 1977 : Les problèmes microbiologiques de la conservation des vins blancs doux – Théorie et pratique de l’utilisation des traitements thermiques. Thèse Docteur-Ingénieur, Bordeaux II. HENSCHKE P.A. et JIRANEK V., 1991 : Int. Symp. on Nitrogen in Grapes and wines, 172-184. KURTZMAN C.P. et DROBY S., 2001: Metschnikowia fructicola, a new ascosporic yeast with potential for biocontrol of postharvest fruit rots. Syst Appl Microbiol 24: 395–399. LIU J., WISNIEWSKI M., DROBY S., TIAN S., HERSHKOVITZ V. et TWORKOSKI T., 2011: Effect of heat shock treatment on stress tolerance and biocontrol efficacy of Metschnikowia fructicola. FEMS Microbiol Ecol 76 : 145–155. LONVAUD-FUNEL A., RENOUF V. et STREHAIANO P., 2010 : Microbiologie du vin : bases fondamentales et applications. Editions Tec&Doc. 241-242. USSEGLIO-TOMASSET L., 1995 : Chimie œnologique, 2ème édition, Tec et Doc, Lavoisier, Paris. 387 p. Articolo a firma di: Olivier PILLET, Institut Œnologique de Champagne (Epernay, Francia) Philippe GABILLOT, Chambre d’Agriculture Indre-et-Loire (Chambray-Les-Tours, Francia) Roberta BELLINI, Perdomini-IOC SpA (Verona)